| ТК СНТТ |
| Структура | Склад | Адреса | Засади | Правопис | Конференція | Семінар | Термінографія | Вісник | Товариство | Комісія | Оголошення | Хто є хто | Архів |
Яворський В. Стандартизація назв хімічних елементів, понять, термінів та визначень хімії – нагальне завдання сьогодення / Віктор Яворський // Проблеми української термінології : міжнар. наук. конф., 29 верес. – 1 жовт. 2016 р., Львів. : доповідь
УДК 546.1
Віктор Яворський
Національний університет «Львівська політехніка»,
кафедра хімії і технології неорганічних речовин
стандартизація назв хімічних елементів, понять, термінів та визначень хімії – нагальне завдання сьогодення*
© Яворський В. Т., 2016
Наведено аналіз Державного стандарту «Елементи хімічні, речовини прості. Терміни та визначення основних понять. Умовні позначення (ДСТУ 2439-94)». Запропоновано змінити українську назву хімічного елемента із символом «Hg» і залишити традиційні українські назви трьох хімічних елементів (F, S, Ni). Рекомендовано ввести у держстандарт поняття – «Нуклони», «Нуклонне число», «Протонне число», «Молекула, «Атомна одиниця маси», «Атомна маса хімічного елемента», «Молекулярна маса речовини», «Моль», «Мольна (молярна) маса», «Хімічний еквівалент елемента і хімічної сполуки», «Валентність» хімічних елементів.
Ключові слова: Держстандарт, поняття, терміни та визначення хімії, хімічні елементи, прості речовини.
The analysis of the State Standard "Chemical elements, substances simple. Terms and definitions of basic concepts. Symbols (ISO 2439-94)". A name change Ukrainian chemical element with the symbol «Hg». A leave traditional Ukrainian names names three chemical elements (F, S, Ni). Сoncept - "Nucleons", "nucleon number", "proton number", "molecule" atomic mass unit", "atomic weight chemical element", "molecular weight substances", "mole", "mole (molar ) weight", "chemical equivalent elements and chemical compounds", "Valence" elements аre recommended in State Standard.
Keywords: State Standard, concepts, terms and definitions chemistry, chemical elements, simple substance.
Постановка проблеми. Утвердження України як європейської держави органічно пов’язано з нагальною необхідністю стандартизації всіх сфер людського буття, зокрема хімії, яка, поряд з фізикою, є фундаментальною природничою наукою, утвердження українських Національних стандартів у якій безумовно сприятиме цьому процесу у споріднених галузях.
Аналіз останніх досліджень і публікацій. До часу виникнення незалежної держави України відбувалась жорстка системна русифікація української мови, планомірна ліквідація надбань української термінологічної науки. Їхній розвиток загалом залежав від змін у російській мові й термінології. Як приклад, наведемо цитату із праці [1] «…нельзя отрываться от русской номенклатуры и не учитывать работу, проведенную в АН СССР. При введении в украинскую номенклатуру нових найменований следует принимать во внимание русскую химическую номенклатуру. Совершенствование и изменение украинской химической номенклатуры должны быть связаны с русской номеклатурой и ее дальнейшим развитием». Як видно, на самостійну творчість місця не залишилось.
В Україні працювали і працюють багато відомих, авторитетних вчених-хіміків, особистостей, патріотів свого народу, які мають ґрунтовні надбання з питань хімічної та хіміко-технологічної термінології. Серед багатьох вчених-хіміків, які займались питаннями термінології і мають вагомі здобутки, слід передовсім назвати такі постаті, як О.Курило, О.Зенкевич, І.Горбачевський, А.Голуб, А.Вовк, М.Ганіткевич та інші. За радянських часів їхні знання, надбання не брали до уваги, відбувався планомірний процес русифікації. Міністерство освіти рекомендувало для студентів-хіміків лише російськомовні підручники [2; 3].
У 1994 р. був введений у дію Державний стандарт України «Елементи хімічні, речовини прості. Терміни та визначення основних понять. Умовні позначення» (ДСТУ 2439-94). Розробником цього стандарту був Київський університет імені Тараса Шевченка (автори: проф. М. Ю. Корнілов, доценти О. А. Голуб, В. І. Замковий, А. О. Каящук, Л. Т. Хабалашвілі). Цей стандарт установив терміни, визначення та літерні позначення для елементів Періодичної системи і простих речовин у галузі хімії, хімічної промисловості та сумісних з ними галузей. Терміни, регламентовані в цьому стандарті, обов’язкові для використання у всіх видах нормативної документації, довідковій та навчально-методичній літературі. Вимоги стандарту обов’язкові для використання в роботі підприємств, установ, організацій, що діють на території України, технічних комітетів з стандартизації, науково-технічних та інженерних товариств, міністерств (відомств).
Минуло понад 20 років з часу введення у дію зазначеного стандарту. Незважаючи на вищевикладену обов’язковість використання положень стандарту в усіх сферах, його втілення у життя відбувається надзвичайно повільно, здебільшого частково, інколи спотворено. Так, наприклад, навчально-наочний посібник для середніх закладів освіти містить низку неточностей, грубих помилок, відхилень від вимог стандарту тощо [4]. Аналізуючи цей посібник, складається враження, що його автори зовсім не знайомі з зазначеним Держстандартом, елементарними положеннями хімії. Так, наприклад, на с. 4 написано: «Катіони – продукти приєднання протонів до нейтральних молекул». Подібними «шедеврами» просто пересичений цей посібник. Не важко передбачити «якість» хімічної підготовки у середніх закладах освіти України, яка ґрунтується на такому посібнику. Викладене створює труднощі у закладах вищої освіти, в яких хімія є профілюючою дисципліною. Крім того, зазначене зумовлює пониження наукового рівня викладання теоретичної хімії у вищих навчальних закладах хімічного профілю.
Зазначені та інші обставини зумовили несприйняття положень цього стандарту хімічною спільнотою України, викликали аргументовану критику авторитетних вчених-хіміків України, з надією на зміни і доповнення.
Мета роботи. Беручи до уваги розпочатий в Україні процес ліквідації радянських стандартів, угоду про асоціацію України з ЄС, кафедра хімії і технології неорганічних речовин Національного університету «Львівська політехніка», яка понад 40 років викладає фундаментальний курс хімічної підготовки фахівців-хіміків – неорганічну хімію, розробила і запропонувала Українському науково-дослідному центру проблем стандартизації, сертифікації та якості зміни та доповнення до ДСТУ 2439-94, які узгоджені з авторитетними хіміками багатьох провідних навчальних закладів України та НАН України. Нижче наведені запропоновані зміни та доповнення до ДСТУ 2439-94 та їх обґрунтування.
І. Назви хімічних елементів
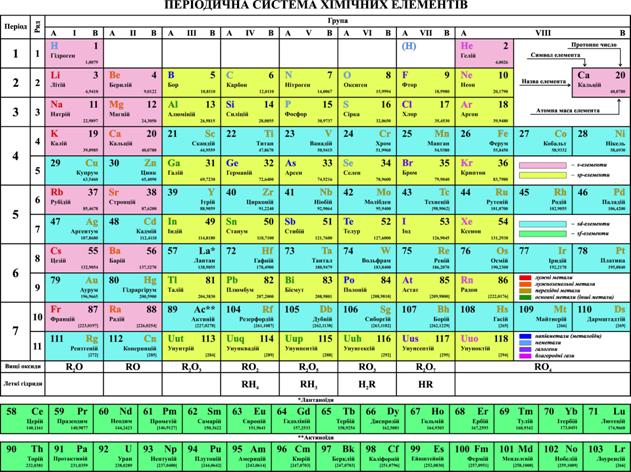
Державним стандартом ДСТУ 2439-94 змінено традиційні назви 19-ти хімічних елементів, які були встановлені за часів радянської влади. Підписання Україною угоди про асоціацію з ЄС вимагає приведення назв хімічних елементів до їхніх символів, які є міжнародними і змінам не підлягають. Отже, прийняття під час розгляду зазначеного стандарту осново закладного принципу повної відповідності назв хімічних елементів до їхніх символів є абсолютно виправданим і відповідає міжнародним стандартам. Відтак зміна назв 15-ти хімічних елементів (перераховані нижче) є повністю обґрунтованою, необхідною.
|
1. |
Н – Гідроген (раніше водень) |
9. |
As – Арсен (раніше миш’як) |
|
2. |
С – Карбон (раніше вуглець) |
10. |
Ag – Аргентум (раніше срібло) |
|
3. |
N – Нітроген (раніше азот) |
11. |
Sn – Станум (раніше олово) |
|
4. |
О – Оксиген (раніше кисень) |
12. |
I – Іод (раніше йод) |
|
5. |
Si – Силіцій (раніше кремній) |
13. |
Au – Аурум (раніше золото) |
|
6. |
Mn – Манган (раніше марганець) |
14. |
Pb – Плюмбум (раніше свинець) |
|
7. |
Fe – Ферум (раніше залізо) |
15. |
Ві – Бісмут (раніше вісмут) |
|
8. |
Сu – Купрум (раніше мідь) |
|
|
У ДСТУ 2439-94 змінено назви, крім перерахованих, ще чотирьох хімічних елементів, а саме:
|
1. |
F – Флюор ( раніше фтор) |
3. |
Ni – Нікол (раніше нікель) |
|
2. |
S – Сульфур (раніше сірка) |
4. |
Hg – Меркурій (раніше ртуть) |
Як видно, традиційні назви трьох хімічних елементів (F, S, Ni) повністю відповідають їхнім символам, тому зміна їхніх назв нічим не обґрунтована, насправді є латинізацією української хімічної мови, що закономірно викликає супротив української хімічної спільноти. Тому запропоновано залишити для цих елементів їхні, дійсно традиційні українські назви: Фтор, Сірка і Нікель.
Назву хімічного елемента із символом «Hg» запропоновано назвати не Меркурій, як це зроблено у Держстандарті, а Гідраргірум, що повністю відповідає вищезазначеному принципу та міжнародним стандартам.
Важливим є те, що Держстандартом залишені без зміни традиційні українські назви простих речовин хімічних елементів, назви яких змінені: Н2 – водень, С – вуглець, N2 – азот, О2 – кисень, Si – кремній, Mn – марганець, Fe – залізо, Cu – мідь, As – миш’як, Ag – срібло, Sn – олово, І2 – йод, Au – золото, Рb – свинець, Ві – вісмут. Зазначене зберігає у широкому вжитку традиційні українські назви, немовби компенсує «втрати» від зміни назв хімічних елементів.
ІІ. Основні поняття, терміни, визначення, позначення
та обґрунтування доцільності їх зміни
2.1. Визначення у Держстандарті атома як «Найменша, хімічно неподільна електронейтральна частинка матерії, що складається з позитивно зарядженого ядра і негативно заряджених електронів» безумовно не відповідає сучасному рівні знань про будову атома. Крім того, заряди (+) і (-) слід називати додатними та від’ємними, а не позитивними і негативними. Враховуючи викладені аргументи, запропоновано таке визначення атома:
Атом. Мікроструктура, що складається з додатно зарядженого ядра та від’ємно заряджених електронів, які перебувають у просторі навколо ядра у стані електронних хмар.
2.2. Поняття «нуклони» у Держстандарті відсутнє, воно є важливим, тому запропоновано доповнити ним Держстандарт.
Нуклони. Складові частинки ядра атома, які перебувають у двох станах – протона і нейтрона.
2.3. Нуклонне число. Кількість нуклонів у ядрі атома. Позначають арабськими цифрами, згори ліворуч від символу хімічного елемента (запропоновано лише доповнити поняття способом його позначення).
Приклади: 1Н, 14N, 16О, 26Fe, 79Au.
2.4. Протонне число. Кількість протонів у ядрі атома. Позначають арабськими цифрами знизу ліворуч від символу хімічного елемента (запропоновано лише доповнити поняття способом його позначення).
Приклади: 1Н, 7N, 8О, 26Fe, 79Au.
2.5. Хімічний елемент. Тип атомів із строго певним протонним числом. Позначають міжнародними латинськими символами, називають відповідно до символа елемента з великої літери.
Приклади: Н – Гідроген, N – Нітроген, О – Оксиген, Fe – Ферум, Au – Аурум.
Запропоноване визначення поняття «хімічний елемент» є лише уточненням наявного у стандарті. Запис назви хімічних елементів з великої літери вважаємо виправданим, оскільки появляється чітка межа між поняттями хімічний елемент і його проста речовина, назву якої прийнято записувати з малої літери.
2.6. Наявне у Держстандарті визначення поняття «ізотоп» як «Атом одного елемента, що має певне нуклонне (масове) число» є не чітким, оскільки не відображає різницю між ізотопами конкретного хімічного елемента. Запропоновано уточнене поняття.
Ізотопи. Атоми хімічного елемента, що відрізняються між собою кількістю нейтронів у ядрі.
Приклади: ![]() ,
,
![]() ,
,
![]() ;
;
![]() ,
,
![]() ;
;
![]() ,
,
![]() ,
,
![]() ;
;
![]() ,
,
![]() ,
,
![]() .
.
2.7. У ДСТУ 2439-94 поняття «молекула» взагалі відсутнє. Це поняття є важливим, оскільки всі індивідуальні речовини є сукупністю молекул або кристалів. Тому пропонуємо доповнити ним Держстандарт.
Молекула. Найменша частинка речовини, носій основних її властивостей.
2.8. Проста речовина. Речовина, утворена атомами одного хімічного елемента. Формули простих речовин записують символами відповідного хімічного елемента із зазначенням знизу праворуч біля символу елемента арабськими цифрами кількості атомів у молекулі (меншим шрифтом, число 1 не записують). Назви простих речовин записують з малої літери (доповнене лише методикою позначення, що сприятиме кращому сприйняттю).
Приклади: Н2 – водень; N2 – азот, О2 – кисень, Сl2 – хлор.
2.9. Трактування у Держстандарті поняття «алотропія» як «Властивість хімічних елементів утворювати декілька простих речовин, що відрізняються за будовою та властивостями» не вірне, оскільки не відображає істотну різницю між алотропами. Будова і властивості алотропів є лише наслідком різної кількості атомів у молекулі. Запропоноване визначення цього поняття усуває цей недолік.
Алотропія. Властивість хімічних елементів утворювати декілька простих речовин, які відрізняються між собою кількістю атомів у молекулі.
Приклади: О2 – кисень, О3 – озон; S2 – дисірка, S8 – циклооктасірка.
2.10. Хімічна сполука (складна речовина). Речовина, утворена атомами різних хімічних елементів. Формули хімічних сполук записують символами відповідних хімічних елементів із зазначенням знизу праворуч біля символу елемента арабськими цифрами кількості атомів кожного елемента у молекулі (меншим шрифтом, число 1 не записують). Назви хімічних сполук записують з малої літери (у Держстандарті це поняття відсутнє).
Приклади: Н2О – вода, Н2SO4 – сульфатна кислота, NaCl – натрію хлорид.
2.11. Іон. Електронодефіцитний або електрононадлишковий атом або група атомів. Заряд іона позначають арабськими цифрами згори праворуч від формули іона із знаком (+) або (-) після числа (меншим шрифтом, число 1 не записують). Додатно заряджений іон – катіон, від’ємно – аніон (наявне у Держстандарті поняття іон доповнене методикою позначення їхніх зарядів та класифікацією на катіон-іон і аніон-іон).
Приклади: К+, Mg2+, Fe3+ – катіони; Cl-, NO3-, SO42- - аніони.
2.12. Атомна одиниця маси. 1/12 частина маси ізотопу
Карбону ![]() .
Позначають а.о.м. (відсутнє у Держстандарті).
.
Позначають а.о.м. (відсутнє у Держстандарті).
2.13. Атомна маса хімічного елемента. Маса атома елемента, виражена в атомних одиницях маси (відсутнє у Держстандарті).
Приклади: атомна маса Н = 1,0079; О – 15,9994; Fe – 55,8470.
2.14. Молекулярна маса речовини. Маса молекули речовини, виражена в атомних одиницях маси, дорівнює сумі мас елементів, що входять до складу молекул. (відсутнє у Держстандарті).
Приклади: молекулярна маса Н2 – 2,0158; О2 – 31,9988; Н2О – 18,0152.
2.15. Моль. Одиниця кількості речовини, є такою її кількістю,
яка містить стільки структурних одиниць (молекул, атомів, іонів, електронів),
скільки атомів міститься в 12 грамах ізотопу Карбону
![]() .
Один моль містить 6,023×1023 структурних одиниць (відсутнє у
Держстандарті).
.
Один моль містить 6,023×1023 структурних одиниць (відсутнє у
Держстандарті).
2.16. Мольна (молярна) маса. Маса одного моля, виражена в масових одиницях маси. Розмірність г/моль, кг/моль (відсутнє у Держстандарті).
2.17. Хімічний еквівалент елемента і хімічної сполуки. Така маса елемента або сполуки, яка реагує з 1 молем Гідрогену (відсутнє у Держстандарті).
2.18. Наявне у Держстандарті визначення поняття «ступінь окиснення» як «Число електронів, що перейшли б до більш електронегативного атома» є неправильним як за суттю, так і за вираженням (замість слів «більш електронегативного» необхідно писати електровід’ємнішого). Запропоноване визначення відображає суть утворення хімічного зв’язку.
Ступінь окиснення хімічного елемента. Кількість електронів, які атом умовно приєднує або віддає під час утворення хімічної сполуки. Характеризує стан хімічних елементів у сполуках. Позначають арабськими цифрами згори над символом елемента з відповідним знаком (+) або (-) перед цифрою. У вільному стані ступінь окиснення елемента дорівнює нулю, у сполуках – від +8 до -4. Позначають ступінь окиснення елементів у лінійних сполуках арабськими цифрами над символом елементів із знаком (+) або (-) перед цифрою.
2.19. Поняття «валентність» хімічних елементів є одним із найважливіших у хімії. З розвитком хімічних знань це поняття змінювалось. У Держстандарті воно відсутнє. Запропоноване визначення валентності відображає суть утворення хімічного зв’язку.
Валентність хімічного елемента. Кількість неспарених (одинарних) електронів, які має атом елемента або може мати у збудженому стані. У збуджений стан атом переходить під час поглинання ним певної кількості квантів енергії. Валентність – величина без знака, змінюється у межах 0…8, характеризує стан вільних елементів.
2.20. Раніше хімічні елементи поділяли залежно від того, який енергетичний підрівень заселює останній електрон атома, на: s-, p-, d-, f-елементи. Місце перебування останнього електрона не несе ніякого змістового навантаження, не характеризує хімічні властивості елементів, які насправді залежать від місця перебування валентних електронів. Запропонований принцип класифікації елементів відображає цю залежність.
Класифікація хімічних елементів. Хімічні елементи класифікують за принципом розміщення валентних електронів на енергетичних підрівнях на: s-, sp-, sd-, sf-елементи. S-елементи розміщені у головних підгрупах І і ІІ груп Періодичної системи: sp-елементи – у головних підгрупах ІІІ…VІІІ груп; sd-елементи – у побічних підгрупах І…VІІІ груп; sf-елементи – у двох горизонтальних рядках, розміщених у нижній частині Періодичної системи елементів.
2.21. Періодична система елементів. Містить: символи хімічних елементів, їхні назви, протонні числа та атомні маси; поділ хімічних елементів на s-, sp-, sd-, sf-елементи; формули оксидів та летких гідридів за групами (проект Періодичної системи елементів наведений нижче).
2.22. Номенклатура хімічних сполук. Хімічні сполуки називають, починаючи з назви катіона (дійсного чи уявного), у родовому відмінку. У випадку проявлення катіоном змінних ступеней окиснення, після назви катіона римськими цифрами у круглих дужках вказують ступінь окиснення.
Приклади:
NO – нітрогену(ІІ) оксид; N2O5 – нітрогену(V) оксид;
Сu2О – купруму(І) оксид; CuО – купруму(ІІ) оксид;
FeSO4 – феруму(ІІ) сульфат; Fe2(SO4)3 – феруму(ІІІ) сульфат.
У заключенні наголошуємо, що в арсеналі Львівської політехніки наявні три підручники з проблем теоретичної хімії, які написані у повній відповідності до вимог ДСТУ 2439-94 та тих змін і доповнень, які запропоновані. Їх використання у навчальних та наукових закладах України сприятиме втіленню норм Держстандарту в життя. Це такі:
1. Віктор Яворський. Основи теоретичної хімії: Підручник, 3-те видання, доповнене та доопрацьоване, 2016. – 378 с.
2. Віктор Яворський. Неорганічна хімія: Підручник, 2-е видання, доповнене та доопрацьоване. 2016, - 310 с.
3. В. Т. Яворський, Т. В. Перекупко, З.О.Знак, Л. В. Савчук. Загальна хімічна технологія: Підручник, 3-те видання, доповнене та доопрацьоване, 2014. – 530 с.
Названі підручники є єдиними в Україні, їх використовують вищі навчальні заклади хімічного профілю України та наукові установи.
Висновок Переконані, що запропоновані зміни будуть позитивно сприйняті хімічною спільнотою та сприятимуть широкому та усвідомленому його застосуванні в усіх сферах людської діяльності.
1. О принципах построения номенклатуры неорганических соединений / А. І. Астахова, Я. Н. Фіалкова // Укр. хим. журн. – 1958. – Т. 24. – № 3. – С. 413–418. 2. Общая и неорганическая химия : учебник для хим.-технол. спец. вузов / Ахметов Н. С. – М. : Высшая школа, 1981. – 679 с. 3. Карапетьянц М. X., Дракин С. И. Общая и неорганическая химия. – М. : Химия, 1981. – 632 с. 4. Вступ до хімічної номенклатури / Білодід О. І., Голуб О. А., Корнілов А. М., Корнілов М. В., Кутрав Г. П., Нерознак С. В., Цимбал Н. А. – К. : Школяр, 1997. – 48 с.
* доповідь подано в авторовій редакції – ред.